法洛四联症(TOF)作为最常见的紫绀型先天性心脏病,其80%以上的非综合征型病例病因未明,遗传机制复杂。纤毛作为细胞信号转导的关键结构,虽被推测参与心脏发育,但在TOF发病中的系统性遗传证据与机制仍不清楚。
2025年10月10日,南京医科大学胡志斌、林苑与顾亚云团队在Science Advances上发表题为《Loss-of-function variants in ciliary genes confer high risk for Tetralogy of Fallot》的研究论文。该研究整合人群基因组学与小鼠模型,首次在中国汉族人群中系统揭示了纤毛基因功能缺失变异在TOF患者中显著富集,且其寡基因突变模式可大幅提升患病风险,并进一步阐明该过程通过破坏Hedgehog信号通路、抑制心脏关键转录因子GATA4与NKX2-5表达下调的分子机制。

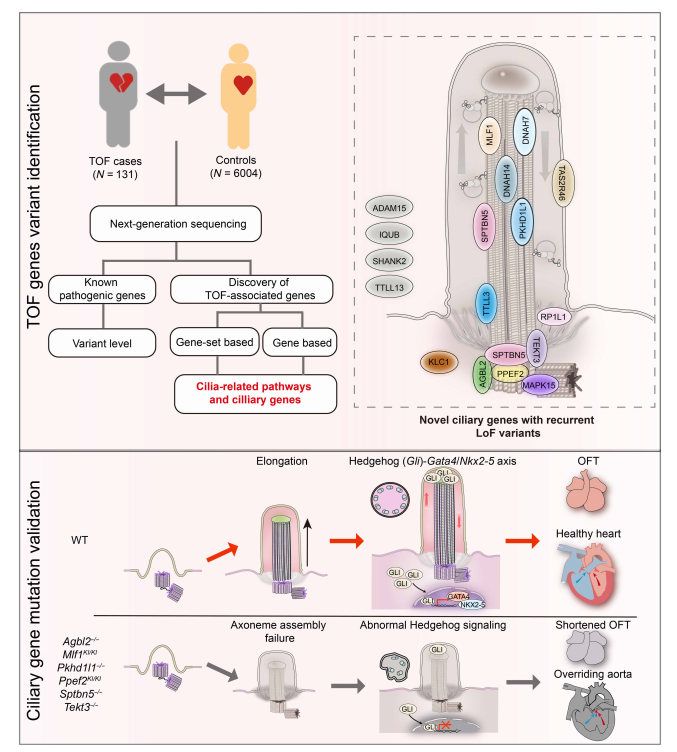
研究团队首先对131例非综合征型TOF患者进行二代测序,发现已知致病基因仅能解释12.21%的病例。进一步通过基因富集分析,发现纤毛通路中致病变异显著富集,66.4%的患者携带至少一个纤毛基因功能缺失变异。尤为关键的是,基因集负担分析揭示了一种多基因累积效应:携带6个及以上纤毛基因有害变异的个体,患病风险提高超过3倍,为理解TOF的复杂遗传结构提供了关键证据。研究团队进一步构建了6个存在复发突变纤毛基因(AGBL2、MLF1、PKHD1L1、PPEF2、SPTBN5、TEKT3)的敲除小鼠模型,成功再现主动脉骑跨、室间隔缺损、肺动脉狭窄等人类TOF核心表型。单基因杂合突变即诱发部分心脏缺陷,而双杂合小鼠表型发生率与严重度均显著升高,有力支持多基因叠加致病的假说。机制研究表明,纤毛基因缺失导致胚胎心脏流出道中纤毛数量减少、长度缩短、轴丝结构紊乱。通过整合RNA-seq、单细胞转录组和CUT&Tag等数据,团队解析出纤毛功能障碍特异性抑制心肌细胞中Hedgehog信号通路活性,进而下调其下游关键转录因子GATA4与NKX2-5的表达,最终导致流出道发育异常与TOF发生。
综上所述,该研究首次在人群与动物模型中系统证实纤毛基因变异是非综合征型TOF的重要致病因素,并明确了其多基因遗传的特征及通过“Hedgehog-GATA4/NKX2-5轴”调控心脏流出的道发育的分子机制。该成果不仅为TOF的遗传咨询与风险预测提供了新靶点,也为复杂先天心脏病的多基因机制研究提供了新范式。
南京医科大学周彦博士后、蒋涛副教授、高继淼博士、臧捷博士和南京市儿童医院心胸外科莫绪明教授为本文的并列第一作者。南京医科大学胡志斌教授、林苑教授、顾亚云副教授为本文的共同通讯作者。
全文链接:https://pmc.ncbi.nlm.nih.gov/articles/PMC12513439/